 По данным Всемирной организации здравоохранения, в мире ежегодно регистрируется почти 10 миллионов новых случаев болезни Альцгеймера — наиболее распространенной формы деменции, вследствие которой человек теряет память и способность ориентироваться в окружающей среде, у него возникают нарушения речи и когнитивных функций. Это седьмая по значимости причина смерти и одна из основных причин инвалидности пожилых людей. Как правило, болезнь Альцгеймера обнаруживается у пациентов старше 65 лет, но сегодня этот недуг «молодеет», в частности, согласно некоторым исследованиям, он развивается как отдаленное последствие перенесенного ковида. На данный момент не существует лекарств, способных остановить или хотя бы замедлить развитие болезни Альцгеймера, есть только препараты, позволяющие временно смягчить симптомы деменции, улучшить когнитивные способности.
По данным Всемирной организации здравоохранения, в мире ежегодно регистрируется почти 10 миллионов новых случаев болезни Альцгеймера — наиболее распространенной формы деменции, вследствие которой человек теряет память и способность ориентироваться в окружающей среде, у него возникают нарушения речи и когнитивных функций. Это седьмая по значимости причина смерти и одна из основных причин инвалидности пожилых людей. Как правило, болезнь Альцгеймера обнаруживается у пациентов старше 65 лет, но сегодня этот недуг «молодеет», в частности, согласно некоторым исследованиям, он развивается как отдаленное последствие перенесенного ковида. На данный момент не существует лекарств, способных остановить или хотя бы замедлить развитие болезни Альцгеймера, есть только препараты, позволяющие временно смягчить симптомы деменции, улучшить когнитивные способности.
Поиск биологически активных соединений, предотвращающих разрушение клеток головного мозга, интенсивно идет во многих странах, в том числе и в России. В этом направлении активно работают сотрудники Института органического синтеза им. И.Я. Постовского УрО РАН под руководством академика В.Н. Чарушина и их коллеги из Института физиологически активных веществ Федерального исследовательского центра проблем химической физики и медицинской химии РАН, с которыми уральцев связывает давнее сотрудничество. Результаты совместных исследований, поддержанных грантом РНФ, опубликованы в журналах “ChemMedChem”, “Archiv der Pharmazie”, “European Journal of Medicinal Chemistry” и др. О сегодняшнем этапе работ мы поговорили с учеными ИОС УрО РАН — с руководителем направления программ и платформ членом-корреспондентом РАН Виктором Салоутиным и зам. директора по научной работе доктором химических наук Яниной Бургарт.
— Мы синтезируем мультитаргетные (от англ. target — цель) соединения, на основе которых могут быть созданы препараты для лечения болезни Альцгеймера. Ключевое слово здесь — мультитаргетный. На языке медицинской науки термин «target» означает также биомишень, — поясняет Виктор Иванович Салоутин. — Разработка любого лекарственного средства связана с поиском биомишени. Но в случае болезни Альцгеймера модель «одна биомишень — одно лекарство» неэффективна, поскольку это заболевание затрагивает многие системы и связи в организме, а главное, до сих пор нет однозначного представления о том, каковы его причины, есть только гипотезы.

Согласно холинергической гипотезе болезнь Альцгеймера развивается в результате снижения синтеза ацетилхолина — вещества, которое принимает участие в передаче нервного возбуждения в центральной нервной системе, вегетативных узлах, окончаниях парасимпатических и двигательных нервов и играет важнейшую роль в таких процессах, как память и обучение. Дефицит ацетилхолина при болезни Альцгеймера приводит к ослаблению памяти и снижению концентрации внимания у пациентов. В организме ацетилхолин расщепляют ферменты — ацетилхолинэстераза и бутирилхолинэстераза. Если применить их ингибиторы — вещества, которые замедляют или блокируют ферментативные процессы, то уровень и продолжительность действия ацетилхолина в центральной нервной системе, вегетативных ганглиях и нервно-мышечных соединениях повысятся. На этом основано большинство современных методов поддерживающей терапии при болезни Альцгеймера, направленных на компенсацию дефицита нейромедиатора ацетилхолина.
Согласно другой гипотезе основная причина и ключевой маркер заболевания — отложение в тканях мозга бета-амилоида — пептида, представляющего собой цепочку из аминокислот. Накопление амилоидных бляшек в коре больших полушарий препятствует передаче нервных импульсов и запускает последовательность нейродегенеративных изменений. По мнению сторонников тау-гипотезы, эти нарушения вызываются отклонениями в структуре тау-белка. В качестве одного из основных механизмов развития болезни рассматривается также окислительный стресс, вызывающий гибель нейронов. В последние годы популярной теорией, объясняющей причины этого нейродегенеративного заболевания, становится также теория нейровоспаления.
Итак, в настоящее время мультифакторная природа болезни Альцгеймера — общепризнанный факт в научном сообществе, поэтому препараты для ее лечения должны быть нацелены сразу на несколько биомишеней.
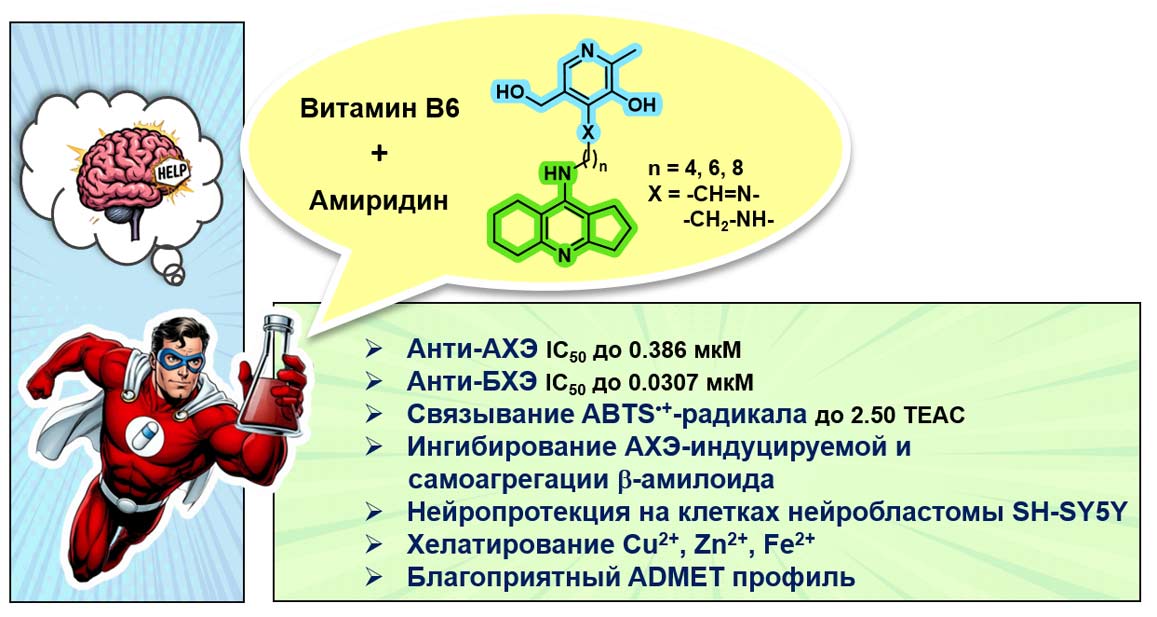
В качестве основы для создания нового мультитаргетного соединения ученые рассматривали два известных антихолинэстеразных препарата (ингибиторы холинэстераз) близкой структуры — такрин и амиридин. Оба они подавляют действие ферментов, расщепляющих ацетилхолин. Такрин — первый препарат, одобренный для улучшения памяти у пациентов с болезнью Альцгеймера. Это мощный ингибитор холинэстераз, однако он оказывает токсическое действие на печень, поэтому сегодня запрещен для клинического применения. А вот амиридин, который используется в медицинской практике, хотя и менее эффективен для улучшения когнитивных способностей пациентов, зато и менее токсичен. Исследования амиридиновой линии соединений, инициированные академиком С.О. Бачуриным, сегодня продолжают сотрудники лаборатории молекулярной токсикологии Института физиологически активных веществ ФИЦ проблем химической физики и медицинской химии РАН во главе с кандидатом химических наук Галиной Махаевой и ученые ИОС УрО РАН.
— Совместно с коллегами из Черноголовки мы работаем над тем, чтобы повысить эффективность соединений на основе амиридина и придать им мультитаргетное действие, — говорит Янина Валерьевна Бургарт. — Для этого мы связываем его молекулу с другими биологически активными блоками с помощью «химического мостика» — алкиленового спейсера различной длины. Присоединение таких блоков придает гибридной молекуле дополнительные свойства. Благодаря варьированию структуры и длины «химического мостика» можно достичь значительного усиления этих свойств.

Как уже говорилось, современные подходы к лечению болезни Альцгеймера предполагают воздействие на несколько биомишеней одновременно. С помощью компьютерного моделирования мы попытались выявить механизмы взаимодействия синтезируемых молекул с активными центрами обоих ферментов — ацетилхолинэстеразы и бутирилхолинэстеразы, а также бета-амилоида. Нам удалось получить мультитаргетные соединения, активность которых в отношении как ацетилхолинэстеразы, так и бутирилхолинэстеразы гораздо выше, чем у самого амиридина. Эксперименты показали, что наши соединения также эффективно блокируют самосборку бета-амилоидных белков и обладают антиоксидантным действием, что потенциально может замедлить прогрессирование заболевания. В качестве второго биологически активного блока наиболее перспективно использовать остатки салициловой кислоты и витамина B6. А тиопроизводные фторированного метилурацила обладают большим потенциалом для создания селективных, то есть избирательно действующих ингибиторов бутирилхолинэстеразы. Дело в том, что у здоровых людей расщепление ацетилхолина идет на 80 % под действием ацетилхолинэстеразы, а на поздних стадиях болезни Альцгеймера это происходит за счет бутирилхолинэстеразы, именно поэтому необходимо разрабатывать селективные ингибиторы и этого фермента.

Исследования новых соединений на основе амиридина в лабораторных условиях на клеточных моделях болезни Альцгеймера показали отсутствие у них гепатотоксичности. Следующий этап — эксперименты на лабораторных животных с перспективой выйти на клинические испытания. В будущем уральским химикам-органикам и их коллегам из Черноголовки предстоит более детально изучить фармакокинетику синтезированных соединений, т.е. закономерности химических и биологических процессов, происходящих с ними в живом организме. Как известно, процесс это очень долгий. И все же осторожный оптимизм вполне оправдан. Полученные результаты — значимый шаг в разработке комплексных препаратов с улучшенным профилем безопасности и эффективности, способных воздействовать на несколько патологических механизмов болезни Альцгеймера одновременно.
Е. ПОНИЗОВКИНА
На фото: В.И. Салоутин, Я.В. Бургарт,
Г.Ф. Махаева с сотрудниками лаборатории молекулярной токсикологии ИФАВ ФИЦ проблем химической физики и медицинской химии РАН
